

水晶体の基礎研究
1. 水晶体透明性の元になる蛋白質
水晶体は何十年もの間、視力を維持するために透明性を保つ必要があります。そのために大切なものが、水晶体を構成する蛋白質の規則正しい構造と相互作用です。水晶体を主に構成する蛋白質は大きく分けてα, β-, γ-クリスタリンの3種類であり、このうちα- クリスタリンはαA-, αB-の2種類、β- クリスタリンはβA1-βA4, βB1-βB3の7種類、γ- クリスタリンはγA-γDとγSの5種類が知られています。これら各種のクリスタリンが、正しい構造をとり、正しく相互作用することで、水晶体は透明性を維持しています。
2. 水晶体の混濁原因となるアミノ酸の化学修飾
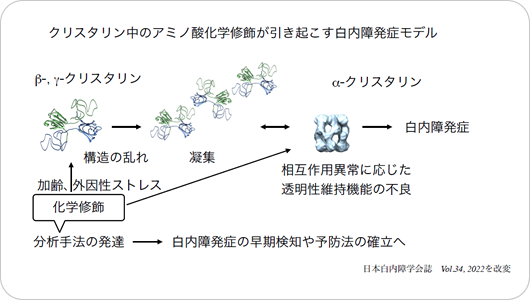
白内障進行の主たる原因は、クリスタリン中で生じるアミノ酸残基の化学修飾によるものと考えられています。外部からの紫外線、内部からの酸化的ストレス、熱などによってクリスタリン中のアミノ酸残基に化学修飾が生じます。これらが蓄積すると、クリスタリンの構造変化、クリスタリン間の相互作用異常、凝集、不溶化がおこり、最終的に水晶体混濁を引き起こします。代表的な化学修飾として1) 酸化、2) 脱アミド化、3)非酵素的糖化、4)異性化、などが報告されています。
1) 酸化
蛋白質中のアミノ酸の一つであるトリプトファンは紫外線の標的アミノ酸の一つです。トリプトファンはUVBを吸収するとキヌレニン誘導体と呼ばれる物質に変化します。これらはUVAを吸収し、その光エネルギーを活性酸素の形で放出します。これら活性酸素が蛋白質中の他のアミノ酸、特にシステイン、メチオニン、ヒスチジンなどを分解し、蛋白質の構造にダメージを与えるということが知られています。 2) 脱アミド化
蛋白質中のアスパラギン、グルタミンは時間経過に応じて脱アミド化反応によりアスパラギン酸、グルタミン酸へと変化します。それぞれのアミノ酸の構造は類似したものですが、大きく違う点は反応後に新しく生じる電荷です。この新しく生じる電荷が蛋白質自身の構造や、他の蛋白質との相互作用を変化させます。 3) 非酵素的糖化
リジンのε-アミノ基と糖のアルデヒドが縮合することによって開始する、メイラード反応による修飾物および架橋産物が、加齢に伴い生体内の蛋白質中で蓄積することが知られています。蛋白質の構造が変化したり、蛋白質同士の間に不都合な結合などが生じ、凝集体が形成すると考えられています。 4) 異性化;(D型およびβ-結合型のアスパラギン酸の生成)
蛋白質中のアミノ酸はすべて、L型と呼ばれるアミノ酸から成り立ち、立体構造が保持されています。しかし、加齢性白内障のクリスタリン中では一部のアスパラギン酸がD型に変化し、同時にこれらの隣接アミノ酸残基との結合がα結合からβ結合へと変化していることが近年、明らかとなっています。これらの部位では電荷の位置が変化することに加え、蛋白質の構造が伸長し、白内障発症の原因になると考えられています。 表1にこれらの修飾と、これらの修飾が起こると蛋白質にどのような変化が生じるかをまとめました。
 白内障は「蛋白質中のアミノ酸の様々な変化」→「蛋白質の構造異常」→「蛋白質の異常凝集」→「発症」という一連の過程を経て生じると考えられています。このプロセスを省みると、水晶体を主に構成する蛋白質=クリスタリンが非常に重要であることが分かります。
 3. 水晶体基礎研究の展望
白内障の発症機構の詳細解明や予防にとって重要なことは、クリスタリン中の、どのアミノ酸に、どのような変化が、どの程度生じているのかを定量的に測定することです。最近では、質量分析を利用することにより測定が容易になってきました。より研究が進展することで、透明性維持機構および混濁機構の詳細を元にした防御物質の探索、定量調査の結果を元にした発症時期の予測などが可能になると考えられます。
|
 |
Copyright© 日本白内障学会 All rights reserved. |